Автор: Портной Сергей Михайлович — онколог-маммолог, хирург, профессор, д.м.н.
Биопсия сигнального лимфатического узла (СЛУ) при раке молочной железы (РМЖ) с cN0 и с конверсией N1 в результате эффективной предоперационной терапии в N0 является операцией, интенсивно осваиваемой онкологами Российской Федерации. Безопасность биопсии СЛУ была доказана в рандомизированных исследованиях. Ограничение объёма вмешательства на подмышечных лимфатических узлах биопсией СЛУ привело к резкому снижению частоты осложнений, связанных с подмышечной лимфаденэктомией, и, прежде всего, частоты лимфостаза верхней конечности. К новым технологиям поиска СЛУ относится технология флуоресцентной лимфографии с использованием индоцианина зелёного (indocyanine green, ICG).
Цель данной публикации — изложение возможности биопсии СЛУ при РМЖ методом флуоресцентной лимфографии с оценкой основных диагностических характеристик метода: частоты нахождения СЛУ и частоты ложноотрицательных ответов.
Анализ источников литературы.
Gould E.A. et al. были первыми, кто обосновал и применил на практике хирургическую тактику биопсии СЛУ. У больных раком околоушной слюнной железы лимфатический узел, находящийся в месте слияния передней и задней лицевых вен, по наблюдению авторов являлся сигнальным. Приводятся сведения о 9 больных, оперированных в 1951-1957 гг. СЛУ удалялся и исследовался интраоперационно гистологически. При нахождении в нём метастаза, производилась радикальная шейная диссекция, если СЛУ не был поражён, диссекция не выполнялась. Четверо больных, которым радикальная шейная диссекция не выполнялась, были прослежены от 2 до 8 лет без признаков рецидива [1]. Нахождение и морфологическая оценка состояния СЛУ, – лимфатического узла, первым воспринимающим лимфу от поражённого злокачественной опухолью органа, позволяют оценить вероятность метастатического поражения других лимфатических узлов. В случае отсутствия такого поражения, – с высокой степенью достоверности предвидеть отсутствие метастазов в последующих лимфатических узлах и отказаться от их удаления без ущерба для эффективности противоопухолевого лечения. Такова концепция биопсии СЛУ, изложенная R. Cabanas в 1977 г. Для поиска СЛУ у больных раком полового члена автор применял рентгеновскую лимфографию с использованием контраста, вводимого в лимфатический сосуд полового члена [2].
Применительно к РМЖ речь идёт о сохранении подмышечных лимфатических узлов и предотвращении осложнений, связанных с подмышечной лимфаденэктомией: лимфатическим отёком верхней конечности, лимфатическим отёком молочной железы (при органосохраняющих операциях), нарушением кожной чувствительности на плече и в подмышечной области. Первоначально биопсия СЛУ применялась у больных РМЖ сT1-2N0M0, в настоящее время показания к её использованию ставятся значительно шире: она применима в тех случаях, когда по данным клинического обследования (пальпация, УЗИ ± тонкоигольная биопсия) отсутствуют признаки метастатического поражения подмышечных лимфатических узлов исходно, то есть, cN0; либо после эффективной предоперационной системной терапии cN1→ «N0» [3,4], а также при выполнении мастэктомии по поводу протокового рака in situ [5].
Безопасность биопсии СЛУ была доказана в рандомизированных исследованиях, ставших фундаментальными для этого раздела онкомаммологии [6,7,8,9,10], а также в метаанализе рандомизированных исследований [11]. Рандомизации подвергались пациенты РМЖ T1-2N0M0 после выполнения биопсии СЛУ. Пациенты с отсутствием метастазов в СЛУ разделялись на выполнение подмышечной лимфаденэктомии (axillary lymph node dissection, ALND) и на отсутствие дополнительной операции (sentinel lymph node biopsy, SLNB). На рисунке 1 и 2 представлены результаты метаанализа рандомизированных исследований, показано отсутствие статистически значимых различий в развитии местно-регионарного рецидива и в развитии смерти от РМЖ.
Рисунок 1. Оценка безопасности технологии биопсии СЛУ при РМЖ. Мета-анализ рандомизированных исследований. 1. Местно-регионарный рецидив. [11]
![Рисунок 1. Оценка безопасности технологии биопсии СЛУ при РМЖ. Мета-анализ рандомизированных исследований. 1. Местно-регионарный рецидив. [11] Биопсия сигнального лимфатического узла](https://vremya-1h.ru/wp-content/uploads/2022/08/biopsiya-portnoj.png)
Рисунок 2. Оценка безопасности технологии биопсии СЛУ при РМЖ. Мета-анализ рандомизированных исследований. 2. Смерть от РМЖ. [11]
![Рисунок 2. Оценка безопасности технологии биопсии СЛУ при РМЖ. Мета-анализ рандомизированных исследований. 2. Смерть от РМЖ. [11]](https://vremya-1h.ru/wp-content/uploads/2022/08/biopsiya-portnoj-s.m..png)
Ограничение объёма вмешательства на подмышечных лимфатических узлах биопсией СЛУ узла привело к резкому снижению частоты осложнений, связанных с подмышечной лимфаденэктомией и, прежде всего, частоты лимфостаза верхней конечности [12].
Нужно ли выполнять подмышечную лимфаденэктомию во всех случаях метастатического поражения СЛУ? При раке cT1-2N0M0 и наличии макрометастазов в 1-2 СЛУ выполнение подмышечной лимфаденэктомии не снижает статистически значимо частоту местно-регионарного рецидива и не улучшает безрецидивную выживаемость и общую выживаемость у пациенток, получающих в последующем лучевую терапию [13, 14], поэтому в рекомендациях StGallen 2021 больным с cT1-2N0M0 и с макрометастазами в 1-2 СЛУ предлагается проведение послеоперационной лучевой терапии без подмышечной лимфаденэктомии [15]. В рекомендациях Минздрава России предлагается другая тактика: «В случаях обнаружения микрометастазов в 1–2 сторожевых лимфатических узлах выполнение лимфаденэктомии не обязательно. В случаях обнаружения метастаза при плановом гистологическом исследовании в одном из исследованных сторожевых лимфатических узлов проведение лучевой терапии на аксиллярную зону в дозе 50 Гр может служить альтернативой подмышечной лимфаденэктомии.» [16]
Для больных раком T1-2N1M0 после эффективной предоперационной системной терапии с исчезновением признаков метастатического поражения лимфатического узла (cN1→ сN0) выполнение стандартной технологии биопсии СЛУ (забор 1-2 лимфатических узлов) сопровождается неприемлемо высоким процентом ложноотрицательных ответов (12,6–14,2%). Для такой категории пациентов выполнение биопсии СЛУ с низкой частотой ложноотрицательных результатов возможно при одновременном удалении ранее маркированного метастатического узла и стандартной биопсии СЛУ, либо выполнение биопсии СЛУ с забором не менее 3 лимфатических узлов [17, 18, 19]. Однако для этой группы пациентов более широкие показания для подмышечной лимфаденэктомии [15] из-за повышения риска рецидива болезни в случае сохранения поражённых лимфатических узлов [20, 21], — подмышечная лимфаденэктомия показана при всех вариантах поражения СЛУ, кроме микрометастаза (менее 2 мм) в одном СЛУ.
Общепринятая в настоящее время технология поиска СЛУ основана на радионуклидной маркировке лимфатических узлов с использованием радиофармпрепаратов, включающих 99mTc. Средний размер частиц радиофармпрепарата может колебаться от 3 до 400 nm [22], однако использование частиц размером менее 100 нм позволяет более успешно находить СЛУ [23, 24]. Большинство методических вопросов отработано при исследованиях с использованием радионуклидной методики. Показано, что место введения лимфотропного препарата: перитуморальное, подкожное над опухолью, периареолярное, внутрикожное в ареолу, субареолярное не имеют значения, любой из них позволяет осуществить успешный поиск СЛУ. Мультицентричность опухоли, предшествующая эксцизионная биопсия опухоли не мешают выполнению биопсии СЛУ [22]. Адекватность технологии поиска подтверждается высокой частотой обнаружения СЛУ (>90%) и низкой частотой ложноотрицательных заключений (<10%). Частота ложноотрицательных заключений является главной характеристикой метода, она демонстрирует, с какой частотой метастатически поражённые лимфатические узлы остаются не удалёнными у пациентов, которым выполняется только биопсия СЛУ. Первое исследование диагностических возможностей поиска СЛУ в России с использованием радиофармпрепарата и красителя было успешным, частота обнаружения СЛУ составила 91,4%, ложноотрицательные ответы получены в 6,4% [25].
Из новых технологий поиска СЛУ можно отметить появление радиофармпрепарата, содержащего молекулу таргетного действия по отношению к Т-лимфоцитам и дендритным клеткам в лимфатических узлах [99mTc-tilmanocept (Lymphoseek®)]. Такой механизм действия и малый размер частиц (7 нм) позволяет радиофармпрепарату быстро попадать в СЛУ и надолго там задерживаться [26]. Технология с использованием наночастиц суперпарамагнитного оксида железа оказалась не хуже по диагностическим возможностям, чем сочетание радиофармпрепарата с красителем [27]. Ультразвуковое исследование с контрастным усилением может иметь достаточно высокие диагностические характеристики [28].
Флуоресцентная лимфография также является относительно новой технологией. Первая публикация по применению ICG для поиска СЛУ без использования эффекта флуоресценции относится к 1999 г. [29]. Успешное обнаружение СЛУ было получено только в 74% из 172 больных РМЖ. Первое использование ICG, основанное на флуоресцентной навигации, также было сделано японскими авторами в 2005 г.: Kitai T., Inomoto T., Miwa M., Shikayama T. СЛУ был обнаружен в 94% [30]. По мнению Ballardini B. et al флуоресцентный метод с индоцианином позволяет находить сигнальный лимфатический узел в 99,6%. Флуоресцентная лимфография с ICG позволяет легко идентифицировать СЛУ с частотой не ниже, чем при использовании радиоактивных препаратов и может использоваться как самостоятельный метод [31]. Флуоресцентная лимфография не уступает радионуклидной технологии по частоте нахождения СЛУ (94-100%) или превосходит её [30, 31, 32, 33, 34].
В нашем исследовании [35] было оперировано 99 больных со 100 случаями рака молочной железы cT1-4N0M0. 12 больных получали предоперационную химиотерапию, 8 – предоперационную гормонотерапию. Подмышечный этап операции состоял из биопсии сигнального лимфатического узла с использованием флуоресцентной лимфографии и лимфаденэктомии I–II или I–II–III уровней. Сигнальный лимфатический узел был найден в 98 случаях (98%). В 28 случаях из 98 (28,6%) были обнаружены метастазы в лимфатических узлах. У больных с N+ метастатическое поражение других лимфатических узлов кроме сигнальных присутствовало только в 35,7%. Ложноотрицательный результат наблюдался в 1 случае из 28 (3,6%). Последовательные этапы процедуры представлены на рисунках 1- 4. Выполнение метода поиска от введения препарата до получения СЛУ занимало 15-30 минут. На рисунке 5 показана редкая, но типичная ситуация. Опухоль в наружных отделах левой молочной железы, введение ICG над опухолью, изогнутая дорожка флуоресценции. При рассечении кожи, подкожной клетчатки, поверхностной и глубокой фасций обнаружены 4 флуоресцирующих лимфатических узла размерами до 5-6 мм; между ними и окончанием флуоресцирующей дорожки располагается плотный узел до 1 см не флуоресцирующий. При гистологическом исследовании в 4 флуоресцирующих лимфатических узлах метастазов не выявлено, в не флуоресцирующем лимфатическом узле – метастаз рака, тотально заместивший лимфоидную ткань.
Рисунок 3. Ведение индоцианина зелёного (0 мин.)
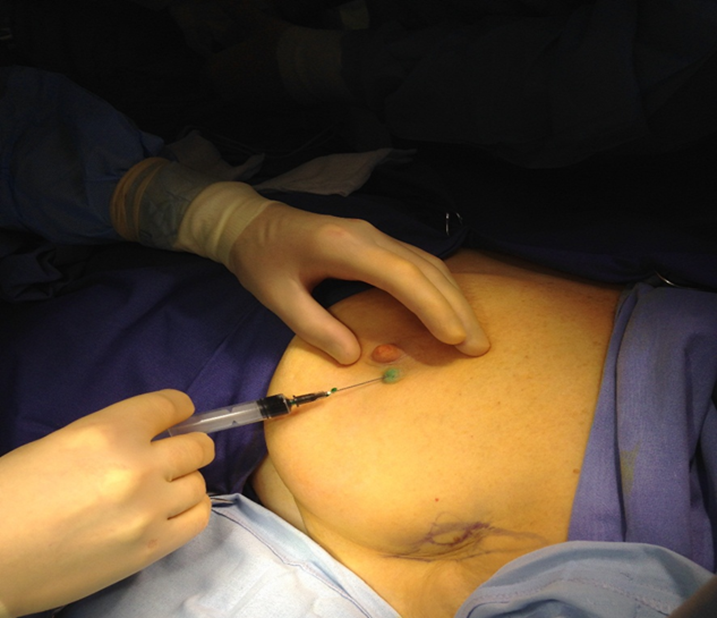
Рисунок 4. Получение изображения доминирующего пути лимфооттока (3 мин.)

Рисунок 5. Флуоресцирующий узел в ране (6 мин.)
Рисунок 6. Флуоресцирующий узел на препарате (14 мин.)
Рисунок 7. Ситуация при тотальном замещении ткани лимфатического узла метастазом. Комментарий в тексте.

Таблица 1. Диагностические характеристики радиоизотопного и флуоресцентного методов биопсии СЛУ.
| Источник | n | Лимфотропный препарат | Частота нахождения СЛУ в % | Частота ложноотрицательных результатов в % |
| В объединённой группе [6-10] | 3502 | 99mTc+/- | 94,9-99,1 | 10,9 (109/1000) |
| С.М.Портной и соавт. [35] | 100 | ICG | 98 | 3,6 (1/28) |
| Метаанализ C.W.Mok et al. [36] | 4244 | ICG | 97,9 | 0,6 |
| 99mTc | 96,5 | 2,6 | ||
| 99mTc+ | 96,7 | 5,5 |
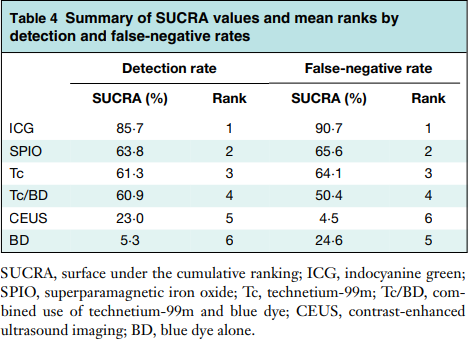
Наши данные, а также данные огромного метаанализа, проведённого C.W.Mok et al. указывают на отличные диагностически характеристики биопсии СЛУ, проводимой с флуоресцентной навигацией. Цитируемый метаанализ ценен тем, что в нём сравнивались разные методы поиска СЛУ. Как видим из таблицы 2, диагностические методы выстроены по диагностической ценности, на первом месте – ICG.
Таблица 2. Сравнительная диагностическая ценность методов биопсии СЛУ. SUCRA- площадь под кривой. ICG – индоцианин зелёный. SPIO — суперпарамагнитный оксид железа; Tc — 99mTc; Tc/BD — 99mTc + блу дай; CEUS — ультразвуковое исследование с контрастным усилением; BD — блу дай. [36]
Выводы. Флуоресцентный метод поиска СЛУ имеет свои технологические особенности: в большинстве случаев СЛУ не визуализируется через кожу, его нужно искать в ране, ориентируясь на ход лимфатического протока. Выполнение метода поиска от введения препарата до получения СЛУ занимает 15-30 минут.
У больных с cN0 метод не уступает радионуклидному методу или его превосходит по основным характеристикам:
- частоте обнаружения СЛУ (98%)
- частоте ложноотрицательных результатов (0,6 — 3,6%).
У больных с cN1 и полным исчезновением признаков поражения лимфатического узла в результате эффективной системной терапии, рекомендуется либо дополнение техники биопсии СЛУ удалением ранее маркированного метастатически поражённого лимфатического узла, либо удаление не менее 3 СЛУ.
Показания для подмышечной лимфаденэктомии 1-2 уровня: при cN0 во всех случаях обнаружения метастазов кроме «обнаружения микрометастазов в 1–2 сторожевых лимфатических узлах. В случаях обнаружения метастаза при плановом гистологическом исследовании в одном из исследованных сторожевых лимфатических узлов проведение лучевой терапии на аксиллярную зону в дозе 50 Гр может служить альтернативой подмышечной лимфаденэктомии.» [16]; при cN1→ N0 подмышечная лимфаденэктомия показана при всех вариантах поражения СЛУ, кроме микрометастаза (менее 2 мм) в одном СЛУ.
Очевидным преимуществом флуоресцентного метода является отсутствие лучевой нагрузки на пациента и персонал. Флуоресцентный метод поиска СЛУ может применяться в самостоятельном варианте.
Рекомендации по технике выполнения биопсии СЛУ с использованием флуоресцентной лимфографии.
Техническое оснащение. Операционная без доступа солнечного света, предпочтительна операционная лампа с источником света, не имеющего инфракрасного компонента, в противном случае на этапе поиска СЛУ освещение нужно выключать. Прибор для ICG-навигации в открытом операционном поле (флуоресцентные системы для эндоскопических операций имеют меньшую площадь приёмки полезной информации). ICG, индоцианин зелёный. Препарат разводится только водой для инъекций.
Биопсия СЛУ – операция, выполняемая под наркозом в первую очередь, до начала операции на молочной железе. Положение пациента лёжа на спине с рукой, отведённой под углом 90 градусов. Зелёный индоцианин в виде водного раствора (5 мг/мл) в объёме 2 мл вводится подкожно по наружному краю ареолы молочной железы или над опухолью. Несколько минут проводится лёгкий массаж в месте введения препарата. Через 2-5 минут можно увидеть флуоресцентное изображение лимфатического пути, идущего к подмышечной области. Изображение на экране монитора в режиме реального времени позволяет зарисовывать на коже пациентки изображение лимфатического протока. Изображение лимфатического узла через не рассечённые ткани можно увидеть менее, чем в 10%, в этом случае можно ожидать его расположение между кожей и поверхностной фасцией или сразу за поверхностной фасцией. Место «обрыва» лимфатического протока, видимого сквозь кожу, является ориентиром для поиска сигнального лимфатического узла в глубине тканей подмышечной области. Через 5-10 минут после введения ICG проводят рассечение, как минимум, кожи, подкожной клетчатки и поверхностной фасции, обычно необходимо также рассечение глубокой фасции. Технической ошибкой будет попытка острым путём проследить ход флуоресцирующего лимфатического протока в ране. В действительности флюоресцирующая дорожка не является жёстко ограниченным протоком, это – доминирующий поток лимфы в лимфатической сети. Повреждение сети приведёт к излиянию ICG в рану и беспорядочному окрашиванию тканей. Для исключения подобной ошибки, нужно представить локализацию лимфатического узла, в который впадает лимфатический проток, и оперативный доступ к этому СЛУ осуществлять со стороны противоположной впадению лимфатического протока в СЛУ. После удаления СЛУ (или узлов) в ране контролируется наличие или отсутствие дополнительных лимфатических узлов как с помощью поиска флуоресценции, так и пальпаторно. И флуоресцирующие, и пальпируемые лимфатические узлы, подозрительные на их метастатическое поражение, расцениваются как сигнальные и отправляются на гистологическое исследование. Предпочтительно (но не обязательно) выполнение срочного гистологического исследования по замороженным срезам с окраской гематоксилином и эозином. На собственно биопсию СЛУ уходит 15-30 минут.
Список литературы
- Gould EA, Winship T, Philbin PH, Kerr HH. Observations on a «sentinel node» in cancer of the parotid. Cancer. 1960.-13.-77-78.
- Cabanas R. An approach for the treatment of penile carcinoma. //Cancer. 1977.-39.-456-466.
- Coates AS, Winer EP, Goldhirsch A, et al. Tailoring therapies—improving the management of early breast cancer: St Gallen International Expert Consensus on the Primary Therapy of Early Breast Cancer 2015. //Ann Oncol. 2015.-26.-1533–1546.
- Curigliano G, Burstein HJ, Winer EP, et al. De-escalating and escalating treatments for early-stage breast cancer: the St. Gallen International Expert Consensus Conference on the Primary Therapy of Early Breast Cancer 2017. // Ann Oncol. 2017.-28.-1700–1712.
- Ansari B, Ogston SA, Purdie CA, et al. Meta-analysis of sentinel node biopsy in ductal carcinoma in situ of the breast. //Br. J. Surg. 2008.-95.-547-554.
- Canavese G, Catturich A, Vecchio C, et al. Sentinel node biopsy compared with complete axillary dissection for staging early breast cancer with clinically negative lymph nodes: results of randomized trial. //Ann. Oncol. 2009.-20.-1001–1007.
- Veronesi U, Paganelli G, Viale G, et al. A Randomized Comparison of Sentinel-Node Biopsy with Routine Axillary Dissection in Breast Cancer. //N Engl J Med. 2003.-349.-546-553.
- Veronesi U, Viale G, Paganelli G, et al. Sentinel lymph node biopsy in breast cancer: ten year results of a randomized controlled study. //Ann Surg. 2010.-251.-595–600.
- Zavagno G, De Salvo GL, Scalco G, et al. A randomized clinical trial on sentinel lymph node biopsy versus axillary lymph node dissection in breast cancer: results of the Sentinella/GIVOM trial. //Ann Surg. 2008.-247.-207-213.
- Krag DN, Anderson SJ, Julian TB, et al. Sentinel-lymph-node resection compared with conventional axillary-lymph-node dissection in clinically node-negative patients with breast cancer: overall survival findings from the NSABP B-32 randomised phase 3 trial. //Lancet Oncol. 2010.-11.-927–933.
- Petrelli F, Lonati V, Barni S. Axillary dissection compared to sentinel node biopsy for the treatment of pathologically node-negative breast cancer: a meta-analysis of four randomized trials with long-term follow up. //Oncol Rev. 2012.-6.-e20.
- Wang Z, Wu LC, Chen JQ. Sentinel lymph node biopsy compared with axillary lymph node dissection in early breast cancer: a meta-analysis. //Breast Cancer Res Treat. 2011.-129.-675–689.
- Giuliano A.E. Ballman K.V, McCall L. et al. Effect of Axillary Dissection vs No Axillary Dissection on 10-Year Overall Survival Among Women With Invasive Breast Cancer and Sentinel Node Metastasis: The ACOSOG Z0011 (Alliance) Randomized Clinical Trial. JAMA 2017;318(10):918–926.
- Donker M, van Tienhoven G, Straver ME, et al. Radiotherapy or surgery of the axilla after a positive sentinel node in breast cancer (EORTC 10981-22023 AMAROS): a randomised, multicentre, openlabel, phase 3 non-inferiority trial. Lancet Oncol. 2014;15:1303-1310.
- J. Burstein, G. Curigliano, B. Thürlimann, et al. Customizing local and systemic therapies for women with early breast cancer: the St. Gallen International Consensus Guidelines for treatment of early breast cancer 2021. Ann Oncology, 32 — 10 – 2021, 1216-1235
- Министерство здравоохранения Российской Федерации. Клинические рекомендации. Рак молочной железы. 2021 https://cr.minzdrav.gov.ru/schema/379_4
- Kahler-Ribeiro-Fontana S, Pagan E, Magnoni F, et al. Long-term standard sentinel node biopsy after neoadjuvant treatment in breast cancer: a single institution ten-year follow-up. Eur J Surg Oncol.2021;47:804-812.
- Boughey JC, Ballman KV, Le-Petross HT, et al. Identification and resection of clipped node decreases the false-negative rate of sentinel lymph node surgery in patients presenting with node positive breast cancer (T0eT4, N1eN2) who receive neoadjuvant chemotherapy. Ann Surg. 2016;263:802-807.
- Kuemmel S, Heil J, Rueland A, et al. A prospective, multicenter registry study to evaluate the clinical feasibility of targeted axillary dissection (TAD) in node-positive breast cancer patients. Ann Surg. 2020. In press, https://journals.lww.com/annalsofsurgery/Abstract/2022/11000/A_Prospective,_Multicenter_Registry_Study_to.66.aspx
- Moo T-A, Edelweiss M, Hajiyeva S, et al. Is low-volume disease in the sentinel node after neoadjuvant chemotherapy an indication for axillary dissection? Ann Surg Oncol. 2018;25:1488-1494.
- Almahariq MF, Levitin R, Quinn TJ, et al. Omission of axillary lymph node dissection is associated with inferior survival in breast cancer patients with residual N1 nodal disease following neoadjuvant chemotherapy. Ann Surg Oncol. 2021;28:930-940.
- Giammarile F, Alazraki N, Aarsvold JN, et al. The EANM and SNMMI practice guideline for lymphoscintigraphy and sentinel node localization in breast cancer. // Eur J Nucl Med Mol Imaging. 2013.-40.-1932–1947.
- Петровский А.В., Афанасьева К.В., Гончаров М.О. и др. Использование различных радиофармпрепаратов при биопсии сторожевых лимфатических узлов у больных раком молочной железы. //Радиационная онкология и ядерная медицина. 2013.- №1.- c.85-89.
- Криворотько П.В., Канаев С.В., Семиглазов В.Ф. и др. Методологические проблемы биопсии сигнальных лимфатических узлов у больных раком молочной железы. //Вопросы онкологии. 2015.- 61.- 3.- c.418-423.
- Вельшер Л.З., Решетов Д.Н., Габуния З.Р., и др. Сторожевые лимфатические узлы при раке молочной железы. //Маммология. 2007.- №1, c.23-25.
- Vera DR, Wallace AM, Hoh CK. A synthetic macromolecule for sentinel node detection: (99m)Tc-DTPA-mannosyl-dextran. //J Nucl Med. 2001.-42.-951–959.
- Karakatsanis A, Christiansen PM, Fischer L, et al. The Nordic SentiMag trial: a comparison of super paramagnetic iron oxi de (SPIO) nanoparticles versus Tc(99) and patent blue in the detection of sentinel node (SN) in patients with breast cancer and a meta-analysis of earlier studies. //Breast Cancer Res Treat. 2016.-157.-:281-294.
- Qiuxia Cui, Li Dai, Jialu Li, Jialei Xue. Accuracy of CEUS-guided sentinel lymph node biopsy in early-stage breast cancer: a study review and meta-analysis. World J Surg Oncol. 2020;18(1):112.
- Motomura K, Inaji H, Komoike Y, et al. Sentinel node biopsy guided by indocyanine green dye in breast cancer patients. // Jpn J Clin Oncol. 1999.-29.-604–607.
- Kitai T, Inomoto T, Miwa M, Shikayama T. Fluorescence navigation with indocyanine green for detecting sentinel lymph nodes in breast cancer. //Breast Cancer. 2005.-12.-211–215.
- Ballardini B, Santoro L, Sangalli C, et al. The indocyanine green method is equivalent to the ⁹⁹mTc-labeled radiotracer method for identifying the sentinel node in breast cancer: a concordance and validation study. //Eur. J. Surg. Oncol. 2013.-39.-1332-1336.
- Hojo T, Nagao T, Kikuyama M, et al., Evaluation of sentinel node biopsy by combined fluorescent and dye method and lymph flow for breast cancer. // Breast. 2010.-19.-210-213.
- Wishart GC, Loh SW, Jones L, Benson JR. A feasibility study (ICG-10) of indocyanine green (ICG) fluorescence mapping for sentinel lymph node detection in early breast cancer. //Eur J Surg Oncol. 2012.-38.-651-656.
- Xiong L, Gazyakan E, Yang W, et al. Indocyanine green fluorescence-guided sentinel node biopsy: a meta-analysis on detection rate and diagnostic performance. // Eur J Surg Oncol. 2014.-40:843-849.
- С.М. Портной, А.В. Кузнецов, Н.М. Шакирова и др. Вопросы онкологии, 2019, 65, № 2, с. 243-249.
- W. Mok, S.-M. Tan, Q. Zheng and L. Shi. BJS Open 2019; 3: 445–452.
Отзывы наших клиентов
Информация о ценах носит уведомительный характер и не является публичной офертой. Стоимость медицинских услуг определяется после очной консультации у специалистов.

